Bindendes Elektronenpaar
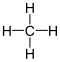
Methan
(CH4) in zweidimensionaler Darstellung. Das Molekül enthält vier
gleichwertige (kovalente) C–H-Bindungen zwischen dem zentralen Kohlenstoffatom
und den vier Wasserstoffatomen.

Methan in dreidimensionaler Darstellung. Die Bindungswinkel zwischen den vier
kovalenten C–H-Bindungen betragen je 109,5°.
Ein bindendes Elektronenpaar ist ein Elektronenpaar, welches zwischen zwei Atomen liegt und damit eine kovalente Bindung zwischen den Atomen bildet. In Valenzstrichformeln werden bindende Elektronenpaare als Strich zwischen Elementsymbolen dargestellt. Im Gegensatz zu Ionenbindungen sind kovalente Bindungen gerichtet.
Durch die gemeinsame Nutzung von bindenden Elektronenpaaren, sowie gegebenenfalls der nichtbindenden Elektronenpaare, können Atome die stabile Elektronenkonfiguration der Edelgase (Edelgaskonfiguration) erreichen.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 09.03. 2025