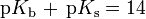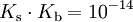
Die Basenkonstante (Kb) ist eine Größe, welche angibt, in welchem Maße eine Base in einem Lösungsmittel alkalisch reagiert. Sie wird eher selten verwendet, da sie sich direkt aus der Säurekonstante Ks berechnen lässt. Es gilt dabei, dass je kleiner der pKb-Wert, desto stärker das Bestreben der Base, Protonen aufzunehmen. Für in Wasser gelöste Säuren und Basen gilt mit dem Dissoziationsgleichgewicht des Wassers bei 25 °C unter Vernachlässigung der Fugazitäten näherungsweise folgende Beziehung:
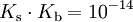
Zwischen einer Base B und ihrer Säure BH+ liegt in wässriger Lösung folgende Gleichgewichtsreaktion vor:
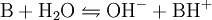
Nach dem Massenwirkungsgesetz wird die Lage des Gleichgewichtes durch die Gleichgewichtskonstante K beschrieben:
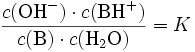
Da die Konzentration
von Wasser 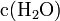 bei der Reaktion praktisch konstant bleibt, lässt sich
bei der Reaktion praktisch konstant bleibt, lässt sich 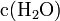 in die Konstante
in die Konstante 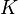 einbeziehen. Damit ergibt sich schließlich die Basenkonstante
einbeziehen. Damit ergibt sich schließlich die Basenkonstante 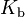 :
:
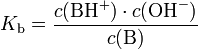
Häufig wird der negative dekadische Logarithmus
von 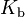 ,
der sogenannte
,
der sogenannte 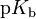 -Wert,
angegeben:
-Wert,
angegeben:
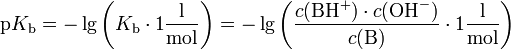
Für den 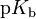 -Wert
und den analog definierten
-Wert
und den analog definierten 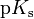 -Wert
gilt bei Zimmertemperatur:
-Wert
gilt bei Zimmertemperatur: