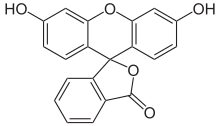
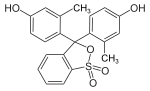
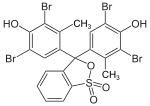
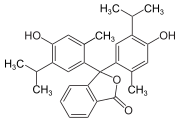
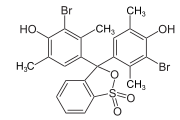
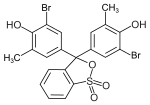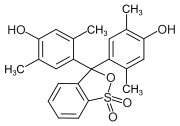Triphenylmethanfarbstoffe
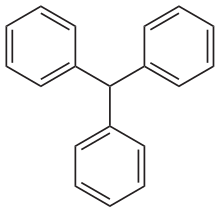
Die Triphenylmethanfarbstoffe leiten sich von Triphenylmethan ab. Verbindungen mit einer intakten Triphenylmethan-Teilstruktur sind farblos. Durch Einführung von elektronenliefernden Substituenten (sogenannte Auxochrome) an mindestens zwei der aromatischen Ringe kann sich ein chinoides System als Chromophor ausbilden, das die Farbigkeit der Verbindungen bedingt. Triphenylmethanfarbstoffe finden hauptsächlich in der Drucktechnik oder (aufgrund ihrer geringen Säurebeständigkeit) als Indikatoren Anwendung, aber auch als Textil- und Lebensmittelfarbstoffe. Sie sind im Allgemeinen wenig lichtecht.
Nach einem 1965 von Siegfried Dähne gemachten Vorschlag sollten die Triphenylmethanfarbstoffe besser als Triphenylmethinfarbstoffe bezeichnet werden, da das zentrale Kohlenstoffatom nicht sp3-, sondern sp2-hybridisiert ist.[1]
Stoffgruppen
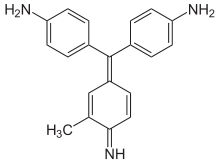
Aminotriphenylmethanfarbstoffe
Die Vertreter dieser Gruppe zeichnen sich durch mindestens zwei Aminogruppen als Auxochrome aus.
- Fuchsin
- Parafuchsin
- Kristallviolett
- Malachitgrün
- Methylgrün
Derivate mit Sulfonsäuregruppe:
- Säurefuchsin
- Brillantblau FCF
- Patentblau V
- Wasserblau
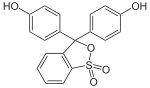
Hydroxytriphenylmethanfarbstoffe
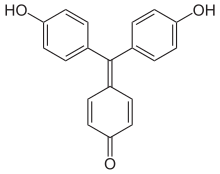
Die Verbindungen dieser Untergruppe enthalten mindestens eine Hydroxygruppe als Auxochrom.
- Fuchson (Diphenylchinomethan) stellt dabei die Stammverbindung dar, jedoch besitzt sie noch keinen Farbstoffcharakter.
- Benzaurin (p-Hydroxyfuchson) ist ein Phenolabkömmling, ist gelbrot und besitzt saure Eigenschaften. Mit verdünnten Laugen entstehen violette Salze.
- Aurin (p,p′-Dihydroxyfuchson) löst sich in Laugen mit roter Farbe und wird als pH-Indikator verwendet.
Phthaleine und Sulfonphthaleine
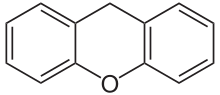
Diese Farbstoffklasse leitet sich von der o-Carbonsäure des Triphenylmethanols ab.
Darstellung
Die Darstellung der Phthaleine erfolgt durch Erhitzen von 1 Äquivalent Phthalsäureanhydrid mit 2 Äquivalenten der Phenolkomponente (in Gegenwart geringer Mengen konzentrierter Schwefelsäure). Zur Darstellung der Sulfonphthaleine wird das 2-Sulfobenzoesäureanhydrid mit der Phenolkomponente umgesetzt. Phenolphthalein bildet die Basisverbindung der Phthaleine und ist einer der bekanntesten Indikatoren. Analog bildet das Phenolrot die Basisverbindung der Sulfonphthaleine.
Setzt man als Phenolkomponente Resorcin, Pyrogallol oder 2,6-Dihydroxytoluol ein, so bildet sich zudem eine Etherbrücke aus (z. B. Fluorescein, Eosin Y, Calcein). Als abzuleitendes Grundgerüst ist hier auch das Xanthen anzusehen.
Strukturen bei verschiedenen pH-Werten
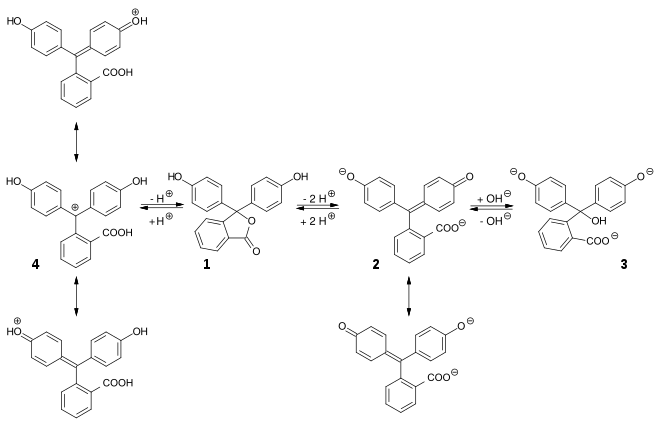
Bei niedrigem pH-Wert liegen die Phthaleine in der farblosen Lacton-Form 1 vor und die Sulfonphthaleine in der ebenfalls farblosen Sulton-Form. In alkalischer Lösung dissoziieren die phenolischen Hydroxy-Protonen und der +M-Effekt bewirkt eine Öffnung des Lacton- bzw. Sulton-Rings zur farbigen, mesomeriestabilisierten chinoiden Form 2.[2] In stark alkalischer Lösung erhält man das farblose Triphenylmethanol-Derivat 3, während in stark saurer Lösung die farbige, mesomeriestabilisierte protonierte Form 4 entsteht.
Verwendung
Nahezu alle Farbstoffe werden als Indikatoren eingesetzt.
Beispiele
| Phenolkomponente | Phthalein | Sulfonphthalein | ||||||
|---|---|---|---|---|---|---|---|---|
Phenol |
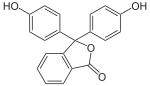 Phenolphthalein |
| ||||||
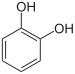 Brenzcatechin |
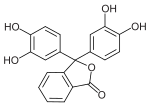 Brenzcatechinphthalein |
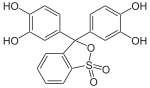 Brenzcatechinviolett | ||||||
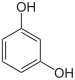 Resorcin |
|
 Sulfonfluorescein | ||||||
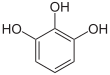 Pyrogallol |
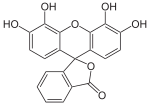 Pyrogallolphthalein |
| ||||||
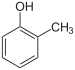 o-Kresol |
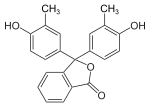 o-Kresolphthalein |
| ||||||
 o-Kresol ( 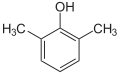 ) )
2,6-Xylenol |
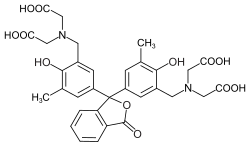 Metallphthalein |
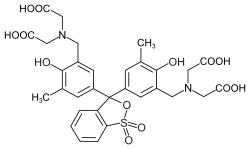 Xylenolorange | ||||||
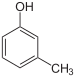 m-Kresol |
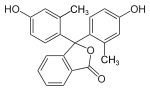 m-Kresolphthalein |
| ||||||
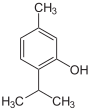 Thymol |
|
| ||||||
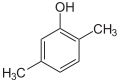 2,5-Xylenol |
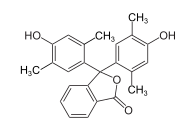 Xylenolphthalein |
| ||||||
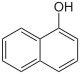 1-Naphthol |
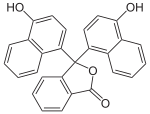 Naphtholphthalein |
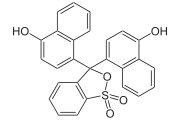 Naphtholsulfonphthalein | ||||||
Literatur
- Z. Tamura, M. Maeda: Differences between phthaleins and sulfonphthaleins, in: Yakugaku Zasshi 1997, 117 (10–11), S. 764–770.
 PDF (jap.)
PDF (jap.)
Einzelnachweise
- ↑ Heinrich Zollinger: Color Chemistry: Syntheses, Properties, and Applications of
Organic Dyes and Pigments. 3. Auflage. WILEY-VCH Verlag, Weinheim 2003, ISBN 3-906390-23-3,
S. 101
(
 eingeschränkte Vorschau in der Google-Buchsuche).
eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Eberhard Breitmaier, Günther Jung: Organische Chemie. Grundlagen, Stoffklassen,
Reaktionen, Konzepte, Molekülstruktur. 5. Auflage. Georg Thieme Verlag, Stuttgart, New York 2005, ISBN 3-13-541505-8,
S. 725
(
 eingeschränkte Vorschau in der Google-Buchsuche).
eingeschränkte Vorschau in der Google-Buchsuche).


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 18.11. 2025