Zinkelektrode
Eine Zinkelektrode besteht aus einer Elektrode aus metallischem Zink in einem Elektrolyten. Zinkelektroden sind ein wichtiger Teil sehr vieler galvanischer Zellen und der entsprechenden Batterien, beispielsweise der Alkali-Mangan-Zellen. Außerdem werden Zinkelektroden bei der galvanischen Verzinkung benötigt. Dazu werden in der Galvanik geeignete Zinkelektrolyte benutzt. Schließlich werden Zinkelektroden als Opferanode im Korrosionsschutz verwendet, z.B. bei Schiffen oder Bootspropellern.
Gleichspannungsquellen (Galvanische Zellen bzw. Batterien) mit Zinkelektrode
In galvanischen Zellen ist die Zinkelektrode das aktive Material an der Minuspolseite, das beim Entladen der Zelle zu Zinksalzen umgesetzt wird. Alle für Batterien praktisch verwendeten Elektrolyte waren und sind wässrig. Sie können sauer, neutral oder alkalisch sein: Beispielsweise enthielten die im 19. Jahrhundert verwendeten Daniell-Elemente Schwefelsäure als Elektrolyt an der Zinkelektrode, während die meisten heute verwendeten Zinkelektroden in einen alkalischen Elektrolyten tauchen, z.B. in den Alkali-Mangan-Zellen.
Die wichtigsten galvanischen Zellen mit Zinkelektrode sind:
- Zellen vom Typ der Zink-Braunstein-Zelle, d.h. solche mit Mangandioxid. Dazu zählen das historische Leclanché-Element, die bis etwa 1980 häufig benutzte Zinkchlorid-Zelle sowie die Zink-Kohle-Zelle, und schließlich die modernen Alkali-Mangan-Zellen.
- die uecksilberoxid-Zink-Batterie mit Quecksilberoxid HgO und das Clark-Normalelement mit Quecksilber(I)-sulfat Hg2SO4.
- die 1800 in London vorgestellte Voltasche Säule – die erste Batterie überhaupt. Ferner weitere historische Zellen wie das Grove-Element, das Bunsenelement mit Kohleelektrode, das Daniell-Element und die Gravity-Daniell-Elemente mit Kupfersulfat CuSO4, und das Edison-Lalande-Element mit Kupferoxid CuO.
- das Chromsäure-Element,
- als wiederaufladbare Zellen der Nickel-Zink-Akkumulator, der Zink-Brom-Akkumulator und der Silber-Zink-Akkumulator,
- die Silberoxid-Zink-Batterie,
- und die häufig als Hörgerätebatterie eingesetzten Zink-Luft-Batterien.
Ausführungen und Herstellung
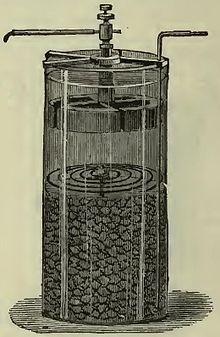
Die ersten Zinkelektroden in der voltaschen Säule waren Zinkplättchen. Nach und nach wurden auch größere Folien oder massive Platten aus Zink eingesetzt. In der zweiten Hälfte des 19. Jahrhunderts wurden manchmal auch komplexere Formen aus massivem Zink verwendet, z.B. die radartige Form mit Speichen in der oberen Hälfte der Zelle im gezeigten Bild. Zinkelektroden werden oft als Zinkbecher ausgeführt, der auch als Behälter für die Zelle dienen kann; solche Behälter können z.B. durch mehrstufiges Tiefziehen aus Zinkblech gefertigt werden.
In vielen modernen Zellen bestehen die Zinkelektroden aus gepresstem Zinkpulver. Wiederaufladbare Zinkelektroden können auf einfache Weise hergestellt werden, indem eine Zinkoxidpaste auf ein Gitter aufgebracht wird; die eigentliche Zinkelektrode entsteht dann beim ersten Laden.
Amalgamierung
Um sicherzustellen, dass eine Batterie vor der Verwendung auch gelagert werden kann, darf die Zinkelektrode nicht durch Korrosion zerfressen werden, da sie dabei keinen Strom liefert. Dies kann – wie schon seit etwa 1840 bekannt ist – am einfachsten dadurch erreicht werden, dass die Zinkelektrode amalgamiert wird. Der elektrochemische Grund für die Verhinderung der Korrosion liegt in der hohen Überspannung des Wasserstoffs an Quecksilber und in einer höheren Überspannung an Amalgam im Vergleich zum Zink. Dadurch wird die Reaktion
soweit erschwert, dass die Lebensdauer der Elektrode verlängert wird. Aufgrund der Giftigkeit des Quecksilbers und seiner Amalgame wurde die Verwendung von amalgamiertem Zink zunehmend eingeschränkt: In der Bundesrepublik Deutschland unterzeichneten am 9. September 1988 Batteriehersteller und die Hauptgemeinschaft des Deutschen Einzelhandels eine freiwillige Selbstbindung. Darin wurde neben der Regelung der Entsorgung auch festgelegt, dass der Quecksilberanteil in den Alkali-Mangan-Batterien in drei Stufen auf unter 0,1 %. gesenkt werden sollte – 1988 betrug er im Durchschnitt noch 0,8 %. Die Selbstverpflichtung, die am 1. April 1989 in Kraft trat, war jedoch nicht sehr wirksam. Am 27. März 1998 trat deswegen die Batterieverordnung in Kraft, 2006 die europäische Altbatterierichtlinie und 2009 das Batteriegesetz.
Zink als Opferanode
Opferanoden aus Zink werden in verschiedenen Formen aus massivem Zink gehandelt. Beispielsweise gibt es Schraubstifte, anschraubbare Ringe oder Barren aus Zink als Zubehör für Boote und ihre Motoren. Zink wird vor allem in Salzwasser verwendet, da für Süßwasser Magnesium noch besser geeignet ist.
Reaktion an der Elektrode, Elektrodenpotential und Kapazität
Das metallische Zink von Zinkelektroden wird bei der Entladung der entsprechenden Zelle bzw. bei der galvanischen Verzinkung oxidiert, d.h., zu Zinkionen (Zn2+) umgesetzt. Diese gehen beim Verzinken immer in Lösung, bei Batterien können sie sich auch als feste Zinksalze auf der Elektrode niederschlagen.
- Oxidation von Zink
In galvanischen Zellen bildet das Zink den Minuspol
der Zelle, da die Elektronenabgabe ‚freiwillig‘, d.h. unter Energieabgabe,
erfolgt. Bei der galvanischen Zinkabscheidung wird die Reaktion durch eine
äußere Spannung erzwungen, wobei die Zinkelektrode mit dem Pluspol der
äußeren Spannungsquelle verbunden wird, so dass dem Zink Elektronen entzogen
werden. Das Standardpotential
einer Zinkelektrode liegt in sauren Lösungen bei −0,763 V gemessen
gegenüber der Standardwasserstoffelektrode
(SHE). In alkalischen Lösungen kommt es zur Bildung von Zinkhydroxid
Zn(OH)2 oder von Zinkaten.
Dabei hängt das Elektrodenpotential
gemäß dem Pourbaix-Diagramm
von Zink vom pH-Wert ab. In sauren Lösungen gilt nach der Nernstgleichung für die
Abhängigkeit von der Zinkkonzentration c(Zn2+):
Bei Raumtemperatur erhält man mit der Ladungszahl ze=+2 für den Wert der Elektrodensteilheit 29 mV und damit die Gleichung
In neutralen und alkalischen Lösungen bildet sich Zinkhydroxid gemäß
Dementsprechend hängt das Potential vom pH-Wert ab, es gilt bei Raumtemperatur für pH-Werte größer als 5,61 (bei c(Zn2+) = 1 mol/l):
Die oben erläuterten sehr negativen Potentiale der Zinkelektrode ermöglicht dan Bau von Batterien, die mit einem wässrigen Elektrolyten eine relativ hohe Spannung liefern. Außerdem hat Zink eine hohe spezifische Ladung (Kapazität) von 820 Ah/kg und damit neben der günstigen Potentiallage auch einen weiteren Vorteil beim Einsatz in Batterien.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 23.03. 2023