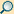Phototransduktion
Phototransduktion heißt die Überführung eines Reizes elektromagnetischer Strahlung in einen zellulären Effekt. Die Umwandlung eines Lichtreizes in ein Rezeptorpotential als physiologisches Signal bei Sinneszellen wird auch photoelektrische Transduktion genannt. Die in den Photorezeptoren der Netzhaut des Auges dabei ablaufende Prozessfolge kann als visuelle Signaltransduktionskaskade bezeichnet werden.
Aufbau der Rezeptorzellen
In das Auge einfallendes Licht trifft auf das Rhodopsin, das in den Diskmembranen in hoher Konzentration (etwa 30.000 Moleküle/µm²) enthalten ist. Disks sind flache, dichtgepackte Vesikel im Inneren des Außensegments der Rezeptorzelle. Sie entstehen als Einfaltungen der Außensegmentmembran. Bei Stäbchen sind diese Einfaltungen von der Plasmamembran gelöst. Sie liegen dort als Diskstapel im Außensegment. Bei Zapfen bleiben sie erhalten.
Der Prozess der Phototransduktion findet hauptsächlich in den Außensegmenten der Photorezeptorzellen (nebenstehende Abbildung) statt. Daran beteiligt sind eine Reihe von membranständigen und löslichen Proteinen. In den Diskmembranen eingelagert findet sich Rhodopsin, ein G-Protein-gekoppelter Rezeptor und eine Guanylatzyklase. Die beteiligten löslichen Proteine sind Transducin, ein heterotrimeres G-Protein, und eine cGMP-Phosphodiesterase. Darüber hinaus befinden sich cGMP-gesteuerte Na+/Ca2+-Kanäle und Na+/K+-Austauscher in der Plasmamembran der Außensegmente. Das Innensegment enthält den Zellkern, die Mitochondrien sowie Na+/K+-ATPasen, einen Na+/Ca2+-Antiporter sowie Kaliumkanäle und ist für den Metabolismus der Zelle zuständig.
Ablauf der Signaltransduktion
Die Signaltransduktionskaskade
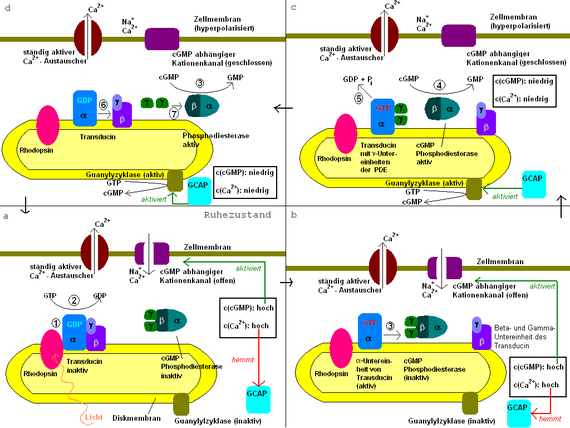
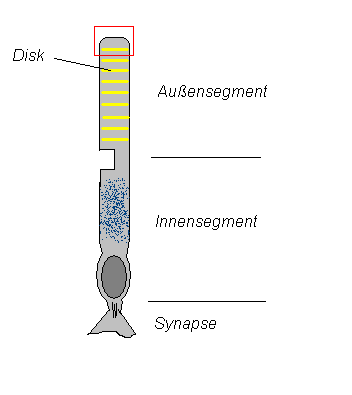
Der genaue Ablauf ist in der nebenstehenden Abbildung dargestellt:
- Das einfallende Licht wird von 11-cis-Retinal, das über eine Schiff-Base-Bindung im hydrophoben Inneren des Opsin an dieses gebunden ist, absorbiert (Rhodopsin ist eine Verbindung von Opsin und 11-cis-Retinal). Dabei isomerisiert das 11-cis-Retinal zum all-trans-Retinal. Daraufhin wird das Rhodopsin über mehrere Zwischenzustände aktiviert. Das aktivierte Rhodopsin (genannt Metarhodopsin II) bindet dann die alpha-Untereinheit des Transducins.
- Diese Bindung induziert in der α-Untereinheit des Transducins den Austausch von GDP gegen GTP. Dies führt im Weiteren dazu, dass die β/γ-Untereinheit abdissoziiert und die α-Untereinheit aktiv wird.
- Die α-Untereinheit des Transducins spaltet die beiden γ-Untereinheiten der cGMP Phosphodiesterase (PDE) ab, bindet sie und aktiviert damit die PDE. Die Abspaltung einer γ-Untereinheit würde zu einer partiellen Aktivierung der PDE führen.
- Die aktive PDE spaltet nun cGMP in GMP. Der sinkende cGMP-Spiegel hemmt den Kationen-Einstrom in die Zelle. Die sinkende Ca2+-Konzentration aktiviert nun das Guanylylzyklase-aktivierende Enzym, das seinerseits die Guanylylzyklase aktiviert. Dadurch wird nun auch cGMP wieder aufgebaut, es stellt sich also ein Gleichgewicht zwischen Auf- und Abbau ein.
- Nach einiger Zeit spaltet die intrinsische GTPase der α-Untereinheit das GTP in GDP und Phosphat. Dadurch werden die γ-Untereinheiten der PDE wieder freigegeben.
- Die so regenerierte α-Untereinheit lagert sich nun wieder mit der β/γ-Untereinheit zusammen und bildet den ursprünglichen Transducin-Komplex.
- Die γ-Untereinheiten binden wieder an die Phosphodiesterase und inaktivieren sie damit. Deshalb wird kein cGMP mehr abgebaut, die Ionenkanäle für Ca2+ und Na+ bleiben geöffnet und bewirken eine Repolarisation der Membran (siehe unten).
Regeneration des Systems
Aktiviertes Rhodopsin (auch Metarhodopsin II) zerfällt zwar nach einiger Zeit in seinen Proteinanteil Opsin und all-trans-Retinal. Letzteres wird mit einer Isomerase wieder in 11-cis-Retinal umgewandelt, das dann erneut an Opsin binden kann. Allerdings dauert dieser Prozess zu lange. Daher wird Rhodopsin über folgende Reaktionsfolge inaktiviert und regeneriert: Rhodopsin wird durch eine Rhodopsinkinase phosphoryliert. An das phosphorylierte Rhodopsin bindet nun Arrestin. Dephosphorylierung des Opsins durch eine Ca2+-sensitive Phosphatase führt zur Dissoziation des Arrestins, woraufhin das Rhodopsin nun wieder mit 11-cis-Retinal regeneriert werden kann. Durch die Arrestin vermittelte Inaktivierung wird verhindert, dass aktiviertes Rhodopsin die Signalkaskade zu lange aufrechterhält.
Arrestin spielt auch eine Rolle bei der Hell-Dunkel-Adaption des Auges, indem die Phosphorylierung und dadurch die durch Arrestin vermittelte Inaktivierung des Rhodopsins mit der Stärke und Dauer eines Lichtreizes zunimmt.
Es findet, wie oben bereits angesprochen, auch ein rückgekoppelter Regelkreislauf über den Ca2+-Spiegel in der Zelle statt (Abb. „Signaltransduktion“ und nebenstehend), die auch an der Regeneration und der Adaptation dieser Prozesse beteiligt ist. Sind die Ionenkanäle geschlossen, strömt kein Ca2+ mehr in die Zelle und der ständig aktive Ca2+-Austauscher befördert Ca2+ aus der Zelle heraus, so dass die Ca2+-Konzentration sinkt. Dieses bewirkt eine Steigerung der Aktivität des Guanylylzyklase-aktivierenden-Enzyms (GCAP) (auch: Guanylatcyclase-aktivierendes-Enzym), die von Ca2+-Ionen inhibiert wird. GCAP aktiviert nun eine cGMP-synthetisierende Guanylylzyklase und der niedrige cGMP-Spiegel wird wieder auf altes Niveau gebracht. Na+-Ca2+-Kanäle öffnen sich wieder durch das cGMP und der Ca2+-Spiegel steigt wieder, wodurch die Aktivität von GCAP und gleichzeitig auch die Guanylylzyklase wieder nachlässt usw. Es entsteht also ein cGMP-Gleichgewicht aus dem Abbau durch die cGMP-PDE und der Synthese von cGMP durch die Guanylylzyklase.
Der entstehende Impuls kann hierdurch auch über den Ca2+-Spiegel reguliert werden und trägt so zur Adaptation an Lichtverhältnisse bei (z.B. durch pH-abhängige Ca2+-Kanäle). Ist der Lichtreiz jedoch vorbei, stoppt die Aktivität der PDE relativ schnell durch die Regeneration von Transducin (von Abschnitt d zu Abschnitt a in Abb. „Signaltransduktion“). Die Guanylylzyklase synthetisiert nun cGMP, sodass dessen Konzentration wieder auf das normale Maß steigt. Dies aktiviert auch wieder den cGMP-abhängigen Kationentransporter und der Dunkelstrom fließt wieder. Auch der Ca2+-Spiegel steigt wieder und stoppt so indirekt die Guanylylzyklase. Das System ist bereit für den nächsten Lichtimpuls.
Signalweiterleitung
Im Dunkeln erfolgt eine fortwährende Ausschüttung des Neurotransmitters Glutamat in den Photorezeptoren. Dieser wirkt bei Zapfen inhibitorisch auf die Horizontal- und ON-Bipolarzellen, aber aktivierend auf die OFF-Bipolarzellen, über unterschiedliche Glutamatrezeptoren (ON-OFF-Dichotomie). Durch die Schließung der Kationenkanäle in der Zellmembran des Photorezeptors und der darauf folgenden Hyperpolarisation wird der Neurotransmitter Glutamat nicht weiter ausgeschüttet. In der Folge werden die hemmenden Ionenkanäle der Horizontal- und Bipolarzellen geschlossen. Dadurch können in den Ganglienzellen wieder Aktionspotentiale entstehen. Dieses ist das eigentliche elektrische Signal, das in der Netzhaut moduliert und schließlich ins visuelle Zentrum des Gehirns weitergeleitet wird.
Siehe auch


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 28.01. 2025