
Sarkomer
| Übergeordnet |
| Muskelfibrille |
| Untergeordnet |
| Mikrofilamente Myosinfilamente I-Band (Biologie) A-Band (Biologie) |
| Gene Ontology |
|---|
| QuickGO |
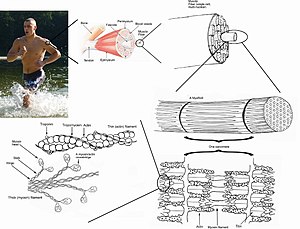
Das Sarkomer (von altgriechisch σάρξ sárx, deutsch ‚Fleisch‘ Gen. σαρκός sarkós „des Fleisches“ und μέρος méros „Teil“) ist die kleinste funktionelle Einheit der Muskelfibrille (Myofibrille) und somit der Muskulatur.
Jedes Sarkomer ist hauptsächlich aus drei mikroskopisch kleinen, kontraktilen Proteinen aufgebaut, die sich zu Filamenten (Proteinfäden) zusammensetzen, welche aus Aktin, Myosin und Titin bestehen. Das Sarkomer hat einen strengen, regelmäßigen Aufbau und ist in Längsrichtung der Myofibrille, die wiederum längs der Muskelfaser gerichtet ist, angeordnet und hintereinander gereiht. Im Ruhezustand hat es eine Länge von etwa 2 bis 2,5 Mikrometern.
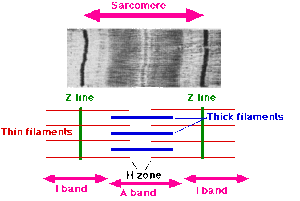
Abschnitte des Sarkomers
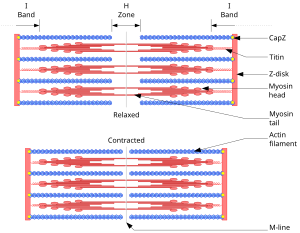
Die Z-Scheiben ("Zwischen"-Scheiben, auch Z-Streifen oder Z-Linien genannt), welche mit den relativ dünnen und daher helleren Aktinfilamenten verbunden sind, begrenzen das Sarkomer an seinen Enden.
An den Z-Scheiben „hängen“ zu beiden Seiten Aktinfilamente (engl.: thin filament), zwischen deren Enden die dicken und daher im mikroskopischen Bild dunkleren Myosinfilamente liegen. Ein Aktinfilament ragt damit in zwei benachbarte Sarkomere.
Die Myosinfilamente sind über das elastische Protein Titin mit jeweils zwei benachbarten Z-Scheiben verbunden und werden dadurch in der Mitte des Sarkomers zentriert.
Die Proteinfamilie der Myosine stellt die Motorproteine des Aktins. Es sind mehr als 15 verschiedene Klassen mit jeweils mehreren Untertypen bekannt. Typischerweise besteht ein Myosinmolekül aus einem Schwanz, der mit anderen Strukturen (zu transportierende Vesikel) oder einem anderen Myosinschwanz verbunden ist, und einem Köpfchen. Das Myosinköpfchen stellt eine ATPase dar, kann also ATP spalten und mit der gewonnenen Energie den Winkel des Köpfchens ändern. Da das Köpfchen an Aktinfilamente binden kann, bewegt sich das Molekül so am Filament entlang. In der Mitte des Sarkomers und damit auch der Myosinfilamente (engl.: thick filament) befinden sich die M-Scheiben (Mittel-Scheiben, auch M-Streifen oder M-Linien genannt). Man geht davon aus, dass M- und Z-Scheiben der mechanischen Querstabilisierung der Aktin- und Myosinfilamente dienen.
Der Bereich um die M-Scheiben wird als H-Zone bezeichnet (Hensen-Zone benannt nach Victor Hensen), dort befinden sich nur Myosinfilamente. Der Bereich um die Z-Scheiben wird als I-Band bezeichnet (I=isotrop, einfach lichtbrechend), dort befinden sich nur Aktinfilamente. Der Bereich zwischen zwei I-Bändern wird als A-Band bezeichnet (A=anisotrop, doppelt lichtbrechend).
Das Myosinfilament ist an M- und Z-Scheibe über das elastische Titinfilament verknüpft, welches am Myosinfilament gebunden zur M-Scheibe verläuft. Aktuellen Erkenntnissen zufolge soll das Titinfilament das Myosinfilament während der Kontraktion zwischen den Z-Scheiben zentrieren und eine Federfunktion übernehmen, daher ist es zu den Z-Scheiben hin federartig gewunden. Die Enden der Aktin- und Myosin-/Titinfilamente überlappen sich. Zusammenfassend sieht die Sequenz der Sarkomerabschnitte folgendermaßen aus: Z – I – A – H – M – H – A – I – Z. Ein Sarkomer besteht also insgesamt aus einem A-Band und zwei halben I-Bändern.
Muskelkontraktion
Bei einer Muskelkontraktion bewegen sich die Aktinfilamente zusammen mit den Z-Scheiben in Richtung der M-Scheibe und den mit ihnen verbundenen Myosinfilamenten. Obwohl bei der Kontraktion die Filamente ihre Eigenlänge mit Ausnahme von Titin nicht verändern, verändert sich die Länge des Sarkomers: Bei einer Kontraktion wird das Sarkomer kürzer, bei einer Dehnung länger.
Muskelkater
Die Reparaturprozesse von Mikroverletzungen der Z-Scheiben, die vor allem durch exzentrische (d. h. abbremsende) Muskelarbeit entstehen, sind eine mögliche Erklärung für Muskelkater.
Literatur
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochemie. 6. Auflage, Spektrum Akademischer Verlag, Heidelberg 2007, ISBN 978-3-8274-1800-5.
- Donald Voet, Judith G. Voet: Biochemistry. 4. Auflage, John Wiley & Sons, New York 2011, ISBN 978-1-11813992-9.
- Bruce Alberts, Alexander Johnson, Peter Walter, Julian Lewis, Martin Raff, Keith Roberts: Molecular Biology of the Cell, 4. Auflage, Taylor & Francis 2002, ISBN 978-0-81533218-3.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 06.01. 2025